生物发光 vs 荧光成像,怎么选?
2025-09-22
生物发光:萤火虫的光搬进实验室
生物发光成像的灵感来自自然界,萤火虫和深海鱼在黑暗中自发光的能力长期吸引着研究者。19世纪末,法国生物学家 Raphaël Dubois 提出了“荧光素(luciferin)/荧光素酶(luciferase)”的概念;而20世纪中期,William D. McElroy团队揭示了萤火虫发光的化学机制,确定这是一类依赖 ATP 的酶促反应,并成功分离出关键发光酶,至此生物自发光的机制基本明确。其核心过程是:荧光素酶催化荧光素在 ATP 和氧气作用下被氧化生成激发态的产物,随后该产物回到基态时释放光子,实现从化学能到光能的转化。
1980年代,分子生物学将该体系用于基因研究:Ow 将荧光素酶基因导入植物,de Wet 应用于哺乳动物,确立其为跨物种、高灵敏、可定量的报告基因;通过体内注射底物即可“点亮”目标细胞。
1990年代中期,这一体系首次用于活体成像。Christopher Contag团队利用细菌发光基因在小鼠体内实现非侵入成像;1997年,他们进一步将萤火虫体系用于哺乳动物,实现了活体基因表达可视化。这一突破使研究者能够动态观察肿瘤生长、基因表达及药物作用,大幅拓展了生物医学研究手段。
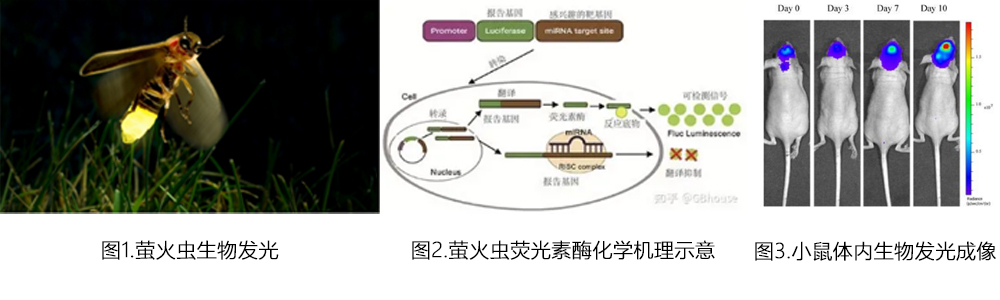
图1.萤火虫生物发光(来源新浪https://k.sina.com.cn/article_3857243723_pe5e8de4b0010057t7.html)
图2.萤火虫荧光素酶化学机理示意(来源知乎https://zhuanlan.zhihu.com/p/670401009)
图3.小鼠体内生物发光成像(来源https://blog.csdn.net/Bio12345/article/details/111992856)
荧光成像:从水母到多色荧光
荧光成像的发展要从绿色荧光蛋白(GFP)说起。1962年,下村修在维多利亚水母(Aequorea victoria)中分离出一种在紫外光下发出绿色荧光的蛋白,并逐步解析其化学特性。1992年,Prasher克隆了 GFP 基因;1994年,Chalfie将其导入大肠杆菌和秀丽隐杆线虫,证明仅表达该基因即可在细胞内产生荧光,而无需额外底物。随后,Roger Tsien通过蛋白质工程显著提高了 GFP 的亮度和稳定性,并拓展至多种颜色变体,奠定了多色荧光成像的基础。三人也因这一系列贡献于2008年获得诺贝尔化学奖。其发光机制是:荧光分子吸收外部特定波长的光子后,电子跃迁至激发态,随后回到基态时释放出能量较低的光子,即我们检测到的荧光信号。
除基因标记外,还开发了多种小分子荧光染料(如 Cy5、Cy7、ICG 等),可与特定分子结合,经外部光源激发实现成像。成像波段也扩展至近红外 NIR-I(650–900 nm)和 NIR-II(1000–1700 nm),以提高组织穿透和信噪比,支持更深部成像。
图1.荧光的 Jablonski 能级图(来源知乎https://zhuanlan.zhihu.com/p/477984559)
图2.落射荧光显微/成像光路(来源物理学报https://wulixb.iphy.ac.cn/cn/article/doi/10.7498/aps.69.20200908)
图3.近红外荧光小鼠成像(来源搜狐https://www.sohu.com/a/617789167_120463448)
图4.华人诺贝尔奖获得者Roger Tsien(钱永健)(来源百度词条)
经过前面的介绍可以看出,生物发光与荧光成像在原理和表现上差异显著。
生物发光和荧光成像有什么本质区别?
生物发光:依赖荧光素酶+底物的化学反应,在体内直接产生光子。无需外部光源,背景噪声极低,信噪比高,尤其适合检测低水平的基因表达或少量细胞变化。底物注射机制还能让发光的时间和部位可控。
荧光成像:依赖外部光源激发,让荧光分子电子跃迁并回到基态时释放光子,信号亮度更高,能够轻松实现多颜色、多靶点同步成像。
它们各自的优缺点是什么?
生物发光:
优点:背景噪声极低,信噪比高,非常适合检测弱信号(如低水平基因表达、少量细胞变化)。发光时机和部位可控(通过底物注射调整)。
缺点:光子产量低,整体亮度不足。空间分辨率有限,多重成像能力较弱(通常单通道)。
荧光成像:
优点:信号亮度高,图像更清晰。多颜色、多靶点成像能力强,可实现多通道同步观察。近红外波段拓展(NIR-I/NIR-II)提高组织穿透力和信噪比,支持深部成像。
缺点:背景自发荧光和散射干扰较大,需要良好的滤光与光路设计。对数据处理和校正要求高,避免假阳性或伪影。
那么,面对具体实验,该如何选择合适的成像模式呢?
什么时候优先选择生物发光成像?
①当研究重点是疾病发展趋势(如肿瘤生长、炎症扩散、感染进展)时。
②需要连续动态监测时,生物发光无需外部光源,背景噪声极低,便于多时间点跟踪。
③在基因表达或细胞存活等低信号实验中,生物发光能提供稳定、可量化的数据。
什么时候优先选择荧光成像?
①当研究需要精确解剖定位,如描绘肿瘤边界、显示器官结构时。
②需要多靶点同时检测(如肿瘤、血管、免疫细胞等)时,荧光的多色探针可实现多通道成像。
③研究对象位于深部组织或是低表达分子时,近红外荧光(NIR-I/NIR-II)能改善穿透和信噪比。
是否可以联合使用两种模式?
如果既需要整体动态信息,又要精确空间定位,联合使用生物发光和荧光成像可以获得更全面的结果。若既需要整体动态信息,又要精确空间定位,联合使用两种模式往往能获得更全面的结果。
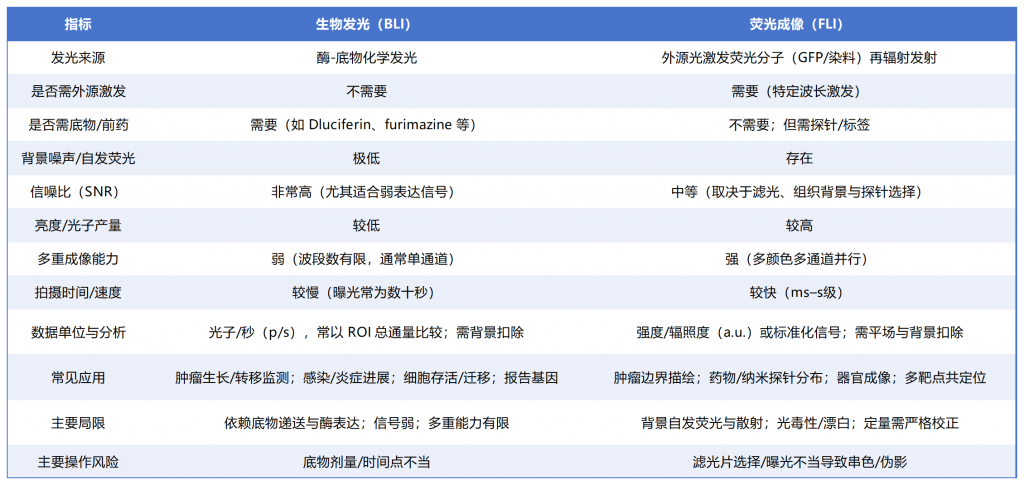
图表.两种成像模式对比
相关产品
为了充分利用生物发光与荧光成像各自的优势,广州光仪生物科技有限公司推出了LASER 系列多模式小动物活体成像系统,既能捕获极微弱的生物发光信号,也可实现多通道荧光成像,满足肿瘤、神经科学、药物分布等多领域研究需求。
|
 |